医药政策周报(2020年第16期)
1. 国家药监局、药品审评中心等部门发布多项《药品注册管理办法》相关配套文件
附件
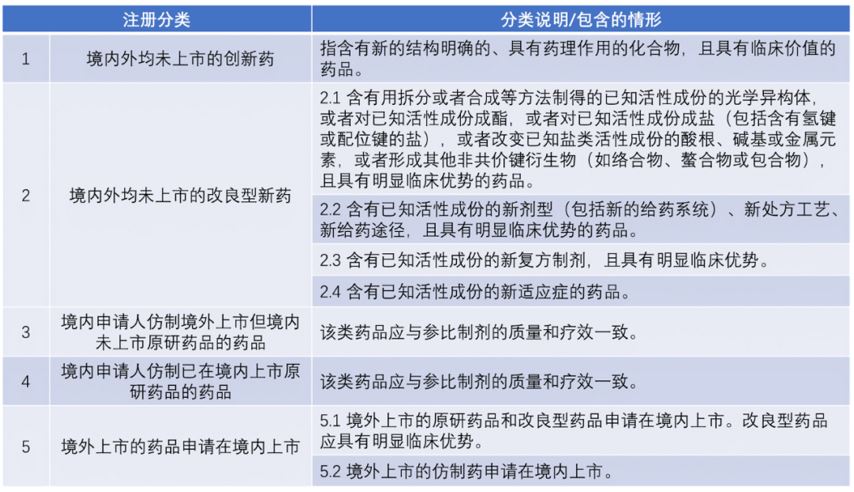

一、《化学药品注册分类及申报资料要求》。其中,化学药品注册分类,自2020年7月1日起实施;化学药品注册申报资料要求,自2020年10月1日起实施,在2020年9月30日前,可按原要求提交申报资料。二、《生物制品注册分类及申报资料要求》。其中,生物制品注册分类,自2020年7月1日起实施;生物制品申报资料要求,自2020年10月1日起实施,在2020年9月30日前,可按原要求提交申报资料。三、《药品注册收费标准》《药品注册收费实施细则》,自2020年7月1日起施行。四、《药品注册检验工作程序和技术要求规范(试行)》,自2020年7月1日起实施。五、《研发期间安全性更新报告管理规范(试行)》,自2020年7月1日起施行。六、《药物临床试验期间安全信息评估与管理规范(试行)》,自2020年7月1日起施行。七、《M4模块一行政文件和药品信息》,自2020年7月1日起施行。八、《化学药品注册受理审查指南(试行)》,包括《化学药品注册受理审查指南(第一部分 注册分类1、2、5.1类)(试行)》《化学药品注册受理审查指南(第二部分 注册分类3、4、5.2类)(试行)》,自7月3日起施行。九、《生物制品注册受理审查指南》,包括《生物制品注册受理审查指南(第一部分 预防用生物制品)》《生物制品注册受理审查指南(第二部分 治疗用生物制品)》以及《生物制品注册受理审查指南(第三部分 按生物制品管理的体外诊断制剂)》,自7月3日起施行。十、《药品记录与数据管理要求(试行)》,自2020年12月1日起施行。十一、《中华人民共和国药典》,自2020年12月30日起实施。
2.药品审评中心发布《GnRH激动剂用于晚期前列腺癌临床试验设计指导原则(征求意见稿)》
前列腺癌是常见的男性泌尿系统恶性肿瘤,GnRH激动剂是晚期前列腺癌重要的治疗手段。国内已有亮丙瑞林、戈舍瑞林、曲普瑞林等相继获得批准,多家企业的产品处于临床研发中,并按照仿制药、改良型新药等不同路径进行申报。该药物在晚期前列腺癌适应症中的临床研究设计和有效性评价终点与其他药物有所不同,因此现阶段需明确和统一国内GnRH激动剂临床试验要求,药品审评中心组织起草了《GnRH激动剂用于晚期前列腺癌临床试验设计指导原则(征求意见稿)》。指导原则对GnRH激动剂的临床试验设计、终点选择等要点提出建议。主要内容包括:“概述”部分介绍了GnRH激动剂的背景及本指导原则的撰写目的及适用范围;“整体考虑”部分,介绍了目前对于该类产品的有效性指标选择、PK/PD相关性、以及基于不同注册分类的临床试验要求;“临床试验设计”部分,详细介绍了临床研究的有效性评价主要终点及次要终点、入组人群、给药周期、合并治疗、安全性信息等内容。
3.药品审评中心发布《药审中心补充资料管理规范(征求意见稿)》
为贯彻落实《药品注册管理办法》有关规定,进一步规范书面发补工作,药品审评中心组织起草了《药审中心补充资料管理规范(征求意见稿)》,并公开征求意见。规范共6章共计23条,主要内容包括:一是明确了补充资料管理规范的适用范围、定义和基本工作原则。二是提出专业审评问询函和补充资料问询函,增加了药审中心主动与申请人就补充资料达成共识的途径,有利于申请人了解审评过程中存在的问题。三是增加了补充资料期间的发补咨询和发补异议处理环节,提高了药审中心和申请人的沟通交流效率,有利于申请人更好理解发补要求并一次性按要求提交全部补充资料。四是增加发补时间到期提醒和终止审评程序,对发补流程进行完善和细化
附件
表1 化学药品注册分类

表2 生物制品注册分类

表3 药品注册收费标准




